Биоптат
Содержание
Исследование и гистологический анализ биоптата
В случаях, когда выбранная диагностическая тактика дает нулевой или малоинформативный результат, применяется более радикальный метод исследования пораженных тканей. Речь о биопсии –процедуре, при которой собирают для лабораторных исследований «живой» материал.
Операция прижизненная, не всегда проводится с высокой травматичностью. Ее результат – биоптат, полученный материал – может дать больше информации о заболевании, чем большинство более щадящих методов распознавания патологий.
Как получают материал для исследований?
Биоптат исследует патоморфорлог. В его же функции входит первичное описание материала по факту получения в зафиксированном виде или без фиксации, рекомендации по точечному гистологическому анализу и постлабораторный анализ изменений.
Получить биоптат можно в ходе операции (пункционной, открытой) или безоперационно (накожные пробы):
- Пункционный способ сбора биоптата: тонкая полая игла резко вводится в область пораженного органа, собирая в полуют трубку весь материал, через который проходит. Инвазия малотравматичная, может проводиться без обезболивания (или с местными анестетиками). Минусы: есть риск не попасть в нужную зону или получить недостаточно биоптата.
- Аспирационный биоптат получают методом «всасывания» содержимого проколотой области или иного органа.
- Биоптат, полученный трепано-иглой. Техника забора материала схожа с первым способом, только вводимая игла снабжена зубцами – на них «оседают» частицы тканей, который проходит инструмент.
Самым информативным способом получения биоптата сегодня является открытая биопсия – инцизионная или эксцизионная. В первом случае часть ткани, которая будет биоптатом, иссекается в ходе хирургической операции, чтобы взять ее кусочек. Во втором биоптатом становится весь пораженный орган или новообразование.
По скорости обработки результатов биопсию делят на срочную (цито) и плановую. В первом случае биоптат исследуется в момент доставки в лабораторию, во втором – может изучаться до 10 дней.
В практике срочной диагностики опасных заболеваний или выявления критических болезней (онкология) для раннего лечения широко распространена прицельная биопсия. В этом случае биоптат забирается многоразовым шприцем с «лапкой захвата» на конце. Для гисто и цитологического исследования может собираться до 5-6 участков.
В случаях, когда орган, чей биоптат требуется, расположен глубоко, процедуру выполняют с визуальным контролем. Это реализовывается через применение эндоскопа, аппаратуры УЗИ.
Условия проведения и допуск к биопсии
Правила забора биоптата.
- Биоптат здорового участка берется на границе с пораженными тканями, часто – с подлежащими волокнами.
- Зоны кровотечений, некроза не могут стать местом сбора биоптата.
- После сбора – немедленная доставка для исследований. При невозможности доставки в лабораторию биоптат должен быть помещен в так называемый фиксирующий раствор (обычно это формалин + спирт в соотношении биоптата с фиксирующим объемом – 1 к 20-30).
Ограничить круг показаний к исследованию биоптата сложно. Если обобщить, то данный метод исследования актуален во всех случаях, в которых высок риск серьезного поражения ключевых органов, или неэффективны прочие методы распознавания болезни.
Наиболее распространена практика забора и изучения биоптата в целях онкологии, гинекологии, урологии (очаговые и абсцессные поражения печени, почек, селезенки). Эффективно исследование биоптата в практике изучения характера новообразований – полипов, кист, опухолевидных тел.
В перинатальной диагностике биоптат собирают, когда:
- в семье есть ребенок с хромосомными отклонениями;
- один из родителей имеет признаки мутации;
- будущей маме 35 и больше лет;
- есть генетические нарушения, связанные с половой принадлежностью;
- при наличии отдельных моногенных отклонений у женщин.
У кого нельзя собирать биоптат?
Запретительными условиями для проведения биопсии и сбора внутреннего биоптата являются нарушенная свертываемость крови, высокая температура, сильная слабость, коматозное состояние. Открытый биоптат не берут при наличии накожных образований, схожих с признаками меланомы.
Будущим мамам нельзя проводить любые инвазии при обильных выделениях, влагалищных кровотечениях, высокой угрозе выкидыша, обострениях ОРЗ и фиброматозных узлов на матке. Биоптат у женщин, которые ждут ребенка или планируют в будущем беременность, не рекомендовано собирать при уже перенесенных операциях на матке.
Источник: https://dobromed.ru/methods/bioptat.html
Что такое биоптат желудка – Лечение гастрита
- 1Что происходит при инфицировании хеликобактериями?
- 2Характерные симптомы
- 3Методы диагностики
- 4Подготовка к уреазному дыхательному тесту
- 5Дополнительные способы выявления Helicobacter pylori
1Что происходит при инфицировании хеликобактериями?
Слизистая оболочка желудка в короткие сроки заселяется этими микроорганизмами. Это происходит за счет специальных жгутиков, которые позволяют бактериям быстро передвигаться. Выделяемые ферменты расщепляют слизистую оболочку желудка.
После закрепления на стенках желудка хеликобактерии вырабатывают уреазу, она повышает концентрацию аммиака и рН. Постепенно слизистая желудка разрушается, это приводит к изъявлениям.
Происходит также нарушение деятельности иммунной системы, развиваются воспалительные процессы.
Факторы риска появления гастрита, дуоденита или язвы желудка:
- Неправильный режим питания и его характер.
- Наличие стрессовых ситуаций.
- Причины, которые повышают выработку желудочного сока и его кислотность.
- Вредные привычки — курение, прием спиртных напитков.
- Наследственный фактор.
- Длительный и бесконтрольный прием некоторых медикаментов, например, нестероидных противовоспалительных средств.
- Наличие инфекционных болезней.
2Характерные симптомы
Наличие следующих признаков должно побудить сдать анализы на хеликобактер пилори:
- Боль в животе во время или сразу после еды.
- Изжога.
- Проблемы с опорожнением кишечника.
- В промежутках между приемами пищи появляются «голодные боли».
- Беспричинная тошнота.
- Тяжесть в желудке, даже если человек съел очень мало.
- Плохое усвоение мясных блюд или непереносимость мяса.
- Боли в желудке ноющего характера, которые присутствуют постоянно.
- Слизь в каловых массах.
- Отрыжка и рвота.
Все эти симптомы указывают на активность хеликобактерий, а значит, и наличие заболевания, связанного с желудочно-кишечным трактом.
Для диагностики этих бактерий понадобится пройти ряд тестов. Нередко они зависят от возможностей медицинского учреждения, куда обратился пациент. Уреазный тест на хеликобактер пилори может быть дыхательным, он наиболее безопасный и результативный.
Показаниями к прохождению теста служат вышеперечисленные симптомы. Противопоказаний практически нет, так как он абсолютно неинвазивен.
Методы диагностики неинвазивного направления:
- Определение титра антител в кровяном русле к антигенам бактерий.
- Выявление антигенов хеликобактерий в каловых массах.
- Уреазный дыхательный тест.
4Подготовка к уреазному дыхательному тесту
Данное исследование проводится на голодный желудок. Пациенту разрешается поесть за 6 часов до проведения теста. Перед процедурой запрещено курить и жевать жевательную резинку.
О приеме лекарственных средств необходимо сообщить доктору, так как они могут искажать результаты теста.
Непосредственно перед тестом почистите зубы и прополощите рот, если доктор не предупредил о том, что этого делать не следует.
Требования перед проведением теста:
- За 2 недели прекратить принимать антибиотики и антисекреторные средства.
- За 5 суток до теста не принимать анальгетики, противовоспалительные и антацидные препараты.
- За 3 дня отказаться от спиртного.
- Нежелательно есть бобовые — фасоль, горох, сою и кукурузу.
Проведение уреазного теста:
- Пациент выпивает 1 стакан жидкости, куда добавляется лимонная кислота. Это необходимо для замедления эвакуации из желудка.
- Через 7-8 минут делается забор выдыхаемого воздуха. Для этого человеку дается специальная трубочка, куда он дышит. После чего трубочка закрывается герметичной крышкой.
- Через 2 минуты необходимо выпить 100 мг мочевины, в которой содержится изотоп углевода с13.
- После этого пациент ложится на кушетку и выполняет круговые движения, чтобы мочевина вступила в контакт со всеми стенками желудка.
- Через 30 мин. делается повторный забор выдыхаемого воздуха.
- Пробирка отправляется в лабораторию.
- Уже через 24 часа можно будет узнать результат анализа. Хранится материал в лаборатории до 10 дней.
Преимущества хелик-теста:
- пациент абсолютно не чувствует боли;
- длится короткое время;
- диагностически достоверен;
- не представляет опасности для детей и беременных женщин;
- в короткие сроки можно узнать результат.
5Дополнительные способы выявления Helicobacter pylori
- Микробиологический способ. Из слизистой желудка или двенадцатиперстной кишки берутся биопаты в стерильных условиях. Данный метод является достоверным, но очень сложным, так как провести его в лабораторных условиях затруднительно.
- Гистология. Данный способ позволяет обнаружить хеликобактерии, а также оценить состояние макрофлоры желудка.
Материалом для исследования является любой участок слизистой желудка и двенадцатиперстной кишки.
- Иммунологические способы.
- Биопсия с цитологией. Забранные клетки из слизистой желудка исследуются под микроскопом. Так как метод приносит много неудобств, чаще всего его используют для пациентов при подозрении на рак или эрозию.
Результат определяется количеством плюсов. 1 плюс — слабое заражение, 3 плюса — сильное заражение. Если плюсы отсутствуют, то это означает, что заражения нет или количество бактерий в норме.
Своевременная и достоверная диагностика болезни позволит начать своевременное лечение. Избавиться от хеликобактерий сложно, но возможно.
Необходимо лишь выполнять все рекомендации врача.
Источник: http://ponos.gastrit-i-yazva.ru/yazva/chto-takoe-bioptat-zheludka/
Биопсия головного мозга: особенности и риски проведения процедуры
В наши дни часто устанавливают диагноз «Опухоль головного мозга». Люди в возрасте утверждают, что раньше подобных заболеваний не было вовсе или они встречались крайне редко. Но так ли это? Современные методы исследования позволяют установить диагноз еще прижизненно, значит, можно лечить болезнь или хотя бы облегчить тяжелое состояние больного.
Медицина совершила множество значительных открытий и прекрасно внедряет инновационные достижения науки и техники. Благодаря активным темпам развития микротехнологий современные невропатологи и нейрохирурги научились проникать в мозг человека с целью диагностики, не нанося ущерба для организма.
Одной из таких диагностических манипуляций является биопсия головного мозга.
Биопсия мозга – это диагностическая процедура, в процессе которой у пациента берут маленький кусочек образования (биоптат) головного мозга для дальнейшего гистологического изучения. На основании полученных данных о биоптате вырабатывают методику лечения, определяя целесообразность и объем оперативного лечения, дозы химио- и лучевой терапии.
Гистология – наука о тканях, которая предполагает изучение тканей на тонких срезах под микроскопом для установления принадлежности клеток, их строения и нормального взаимодействия.
Показания для проведения биопсии
К биопсии прибегают в тех случаях, когда собранной информации другими методами исследований недостаточно. Взятие биоптата – это крайняя мера в диагностике заболеваний нервной системы.
Биоптат головного мозга берут при подозрении на:
- Опухоли головного мозга (степень злокачественности).
- Заболевания воспалительного генеза (менингит, энцефалит).
- Деменционные расстройства (болезнь Альцгеймера, Крейтцфельда-Якоба).
- Рассеянный склероз.
Виды
В настоящее время существует несколько видов биопсии головного мозга, отличающихся по травматичности и течению послеоперационного периода:
- Открытая биопсия головного мозга.
- Стереотаксическая биопсия головного мозга.
- Пункционная биопсия мозга.
Открытая биопсия является самой опасной из-за объема хирургического вмешательства, хотя и используется чаще всего. Вмешательство проводят в условиях операционной. При этой методике пациент находится под общим наркозом. Этапы проведения:
- нейрохирурги делают отверстие в черепе;
- забирают часть кости, оставляя трепанационное окно;
- через трепанационное окно удаляют опухоль;
- после операции дефект закрывается хирургической пластиной или собственной костью.
При выраженном отеке мозга дефект оставляют открытым, прикрывая его лишь кожным лоскутом. Такое решение принимается индивидуально в зависимости от тяжести процесса, так как несет в себе опасность дополнительного инфицирования. Биоптат берут из удаленной опухоли.
За счет введения пациента в наркоз, большого объема операции и ее значительной травматичности такая биопсия имеет свои последствия. Послеоперационный период устанавливается врачом в каждом случае индивидуально с учетом состояния пациента.
Проведении стереотаксической биопсии:
- на голову пациента надевают специальную стереотактическую раму, тем самым фиксируя голову в одном положении;
- вмешательство производится под контролем МРТ или КТ. Возможно проведение МРТ с последующим занесением результатов обследования в специально разработанную программу – систему нейронавигации. Такое новшество значительно облегчает работу нейрохирурга;
- в предварительно выбранном локусе на черепе нейрохирург делает разрез до 1 см, затем осторожно просверливает саму кость черепа.
- в отверстие вводится пункционная игла с установленным на ней светодиодом для освещения и микрокамерой. Изображение с камеры передается на монитор в режиме реального времени. Благодаря этому нейрохирург имеет возможность тщательно изучить опухоль и выбрать оптимальное место для пункции. После того как биоптат взят, разрез зашивают.
Пункционная биопсия головного мозга – наименее травматичная операция.
Для ее проведения надрезают кожу на голове в точке предполагаемого роста образования, затем просверливают отверстие в кости и тонкой полой пункционной иглой проникают в полость черепа. Биоптат берут из определенной точки опухоли.
Стереотаксическая и пункционная биопсия – более современные и усовершенствованные методы исследования, поэтому несут меньшую угрозу для жизни и здоровья пациента.
Опасности исследований
Как и любая другая инвазионная (проникающая) процедура, биопсия имеет ряд противопоказаний и осложнений.
Исследование не проводят в острый период воспалительных заболеваний и на поздних стадиях опухолевых процессов, когда выяснение структуры опухоли не играет роли для лечения, а исход предопределен, также при тяжелой сопутствующей патологии, нарушении системы свертываемости крови.
К осложнениям после проведения диагностической биопсии относят:
- инсульт;
- кровотечение;
- отек на месте забора биоптата;
- кому;
- инфекции.
После выполнения стереотаксической и пункционной биопсий пациент не задерживается в стационаре, а в первые сутки возвращается домой и на 7 день – к повседневным делам. Реабилитация при открытой методике занимает больше времени и протекает у каждого пациента индивидуально.
Оцените эту статью:
Всего : 147
4 147
Источник: https://mozgius.ru/bolezni/diagnostika/biopsiya-golovnogo-mozga.html
Микробиологическое исследование биоптатов стенки толстой кишки у больных с язвенным колитом
Язвенный колит (ЯК) — распространенное заболевание, с наблюдаемой тенденцией к ежегодному увеличению случаев выявления. Преимущественно поражаются лица молодого и трудоспособного возраста [1]. Пик заболеваемости приходится на возрастной период 20–29 и 50–55 лет [2, 3].
При неэффективности консервативной терапии или развитии осложнений заболевания, оперативные вмешательства при ЯК выполняются у 10–20% пациентов, с летальностью 12–50%. Этиология ЯК до сих пор неизвестна [1, 4]. Одним из важных факторов, осложняющих его течение, является микрофлора толстой кишки, которая может влиять на процесс обострения заболевания.
При воспалительных заболеваниях кишечника у больных нарушена иммунологическая толерантность к бактериям, населяющим желудочно-кишечный тракт [5, 6]. При развитии ЯК нарушается барьерная функция слизистой толстой кишки, при этом бактериальные агенты могут проникать в глубокие ткани кишки, запуская каскад воспалительных и иммунных реакций [5–8].
Нарушение целостности слизистой оболочки создает благоприятные условия для обсеменения транзиторной микрофлорой пораженного участка [9].
Микроорганизмы, находящиеся в слизистой оболочке и на поверхности язвенно-некротических образований, принимают непосредственное участие в развитии обострений ЯК. С целью уменьшения бактериального воспаления назначают антибактериальные препараты [1–4]. В настоящее время отсутствует единое мнение о применении антибактериальной терапии у пациентов с ЯК.
Целью настоящего исследования было улучшение результатов лечения пациентов с язвенным колитом путем коррекции антибактериальной терапии на основании данных микробиологического исследования микрофлоры подслизистого слоя толстой кишки.
Материалы и методы исследования
Обследовано 35 пациентов с ЯК в возрасте от 28 до 61 года, средний возраст пациентов 37,6 года, которые находились на амбулаторном и стационарном лечении в отделениях колопроктологии и гастроэнтерологии Клиник СамГМУ с января по май 2017 г. Мужчин было 18 (51,4%), женщин 17 (48,6%) (табл. 1).
Критерии включения в исследование: пациенты обоих полов в возрасте от 20 до 70 лет включительно, подписавшие информированное согласие, с впервые выявленным ЯК или перенесшие не более двух атак заболевания; левосторонний или тотальный уровни поражения; отсутствие в лечении биологической терапии.
Критерии исключения из исследования: возраст меньше 20 лет или старше 70 лет; сахарный диабет, симптомы декомпенсации хронической сердечной недостаточности, наличие системных аутоиммунных заболеваний или онкопатологии, психические заболевания, препятствующие проведению обследования, беременность или кормление грудью, недееспособность пациента, хронические специфические инфекции — туберкулез, ВИЧ-инфицирование (СПИД) и др., судимость либо нахождение под следствием на момент начала исследования, отказ от сотрудничества и несоблюдение медицинских рекомендаций.
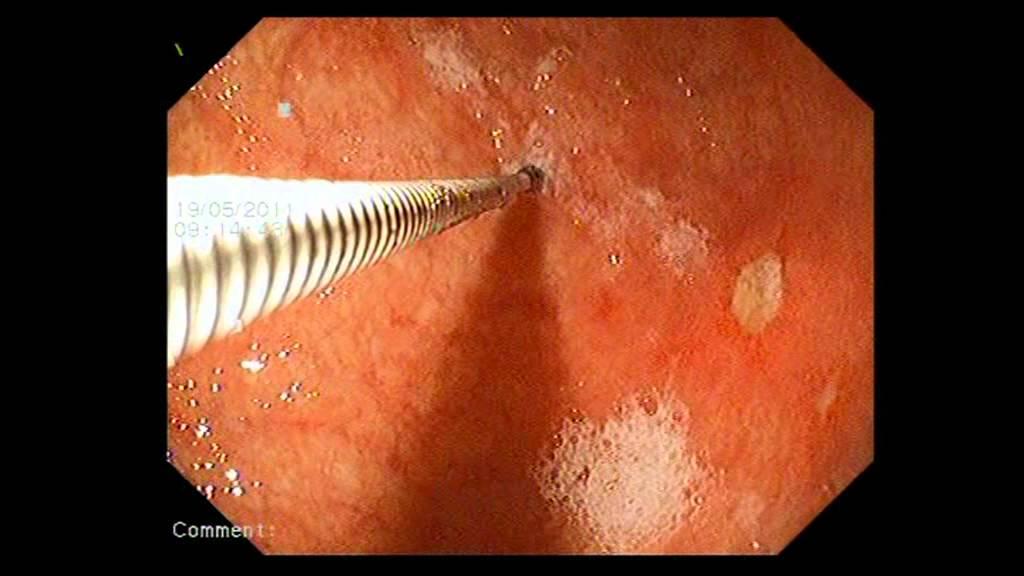
Всем больным выполнялись стандартные клинические и лабораторные исследования, ирригоскопия, ректороманоскопия, фиброколоноскопия с биопсией.
Тяжесть ЯК оценивали по критериям J. G. Truelove и L. I. Witts (1955) с дополнениями Е. А. Белоусовой [4, 10]. Легкая форма ЯК была у 4 (11,4%), среднетяжелая у 18 (51,5%), тяжелая у 13 (37,1%) пациентов (табл. 2).
Проктит выявлен у 16 (45,7%), левосторонний колит у 11 (31,4%), тотальное поражение у 8 (22,9%) больных.
Терапия включала базисные препараты, содержащие 5-аминосалициловую кислоту (месалазин), фолиевую кислоту, стероидные гормоны (преднизолон, гидрокортизон) и симптоматические средства (спазмолитики — папаверин, Но-шпа).
Препараты месалазина являются средством базового лечения ЯК легкого и среднетяжелого течения. Помимо противовоспалительного действия, заключающегося в ингибировании липооксигеназного пути метаболизма арахидоновой кислоты, торможения синтеза и освобождения простагландинов и лейкотриенов, ингибировании провоспалительных цитокинов, антиоксидантном действии и др.
, месалазин обладает и антимикробным эффектом. Показано, что месалазин ингибирует бактериальный рост, подавляя активность генов, ответственных за метаболизм, рост и ответ кишечных бактерий (Kaufman et al., 2009). Антимикробные свойства 5-аминосалициловой кислоты в отношении различных бактериальных штаммов (C. perfringens, C. difficile, C. botulinum и C.
tetani) защищены патентом США в 2001 г. (US Patent 6326364).
В качестве лекарственного препарата месалазина мы применяли Салофальк в различных лекарственных формах (для перорального приема — гранулы и таблетки, для ректального введения — свечи, клизмы, пена).
Выбор именно Салофалька в нашем исследовании обусловлен, во-первых, многообразием лекарственных форм месалазина, что позволило подобрать оптимальный режим терапии в зависимости от локализации воспаления. Так, при проктитах мы применяли свечи Салофальк в дозе 1–1,5 г/сут или ректальную пену в дозе 1 г/сут.
В некоторых случаях проктосигмоидита применялась комбинация из местных и пероральных форм препарата; учитывая более высокую эффективность гранул по сравнению с таблетками в терапии дистальных форм колита (L. Leifeld et al., 2011), предпочтение отдавалось гранулам Салофалька.
Терапия левостороннего и тотального колита состояла в основном из комбинации клизм (2–4 г/сутки) или пены (1–2 г/сут) и гранул Салофалька (в дозе 3 г/сутки) или таблеток (доза 3–4 г/сут).
Согласно современным европейским и российским рекомендациям комбинированная терапия, за счет гораздо более высокого (чем при монотерапии) уровня месалазина в слизистой оболочке кишечника, более эффективна по сравнению с монотерапией только пероральными препаратами.
Во-вторых, было показано, что, несмотря на то, что все препараты месалазина позволяют достичь ремиссии, время до наступления улучшения может существенно отличаться. Максимально быстрое разрешение симптомов (стул ≤ 3 сут) с полным прекращением ректального кровотечения достигается при использовании гранул Салофалька — уже на 11–12 день (рис.
) (W. Kruis и соавт., 2009; V. Gross и соавт., 2011). С клинической точки зрения эти данные являются крайне важными для оценки терапевтического ответа на терапию месалазином и определения дальнейшей тактики лечения (продолжение терапии месалазином или назначение системных стероидов), поскольку, согласно современным рекомендациям, данный ответ следует оценивать на 14-й день. Разница в скорости наступления эффекта обусловлена различным профилем высвобождения месалазина у разных препаратов.
https://youtube.com/watch?v=OiDh2FGZz5Y
При среднетяжелой и тяжелой формах ЯК пациентам назначали инфузионную терапию, аминокислоты, хлористый калий, витамины группы B, гемостатические препараты, парентеральное питание, антибактериальную терапию в соответствии с данными микробиологического исследования микрофлоры биоптата стенки кишки.
Собирался биопсийный материал язвенных поражений слизистой оболочки толстой кишки во время проведения фиброколоноскопии или ректороманоскопии до начала лечения и после выполнения колопроктэктомии (n = 7).
Сбор материала проводили в соответствии с методическими указаниями МУ 4.2.2039–05 «Техника сбора и транспортирования биоматералов в микробиологические лаборатории» и клиническими рекомендациями.
Собирался биопсийный материал язвенных поражений слизистой оболочки толстой кишки во время проведения фиброколоноскопии или ректороманоскопии. Выделенные культуры идентифицировали с использованием MALDI-TOF масс-спектрометрии.
У всех выделенных культур определяли антибиотикорезистентность диско-диффузионным методом в соответствии с клиническими рекомендациями и методическими указаниями МУК 4.2.1890–04 «Определение чувствительности микроорганизмов к антибактериальным препаратам».
У всех энтеробактерий дополнительно определяли фенотипы продукции β-лактамаз расширенного спектра действия методом двойных дисков с цефалоспоринами III поколения и амоксициллином/клавулановой кислотой [6, 8].
Результаты и их обсуждение
Из биопсийного материала 35 пациентов было выделено и идентифицировано 65 штаммов микроорганизмов. Видовой состав выделенных микроорганизмов представлен в табл. 3.
У 6 пациентов (20%) микроорганизмы были выделены в монокультуре, у 24 пациентов (68%) было выделено от 2 до 4 штаммов, у 3 (4%) пациентов определено 5 штаммов микроорганизмов. Роста микрофлоры не было выделено из двух проб биопсийного материала (8%) пациентов.
Выделено 34 штамма в титре 105 КОЕ в биоптате, 4 штамма — в титре 106 КОЕ в биоптате, 15 штаммов — в титре 104 КОЕ в биоптате, 7 штаммов — в титре 103 КОЕ в биоптате.
С учетом видовых особенностей, факторов патогенности и данных по участию микроорганизмов в воспалительных процессах в толстой кишке выделенную микрофлору можно разделить на три группы:
1) представители нормальной микрофлоры толстой кишки — 16 штаммов;
2) микроорганизмы, участие которых в процессе воспаления неизвестно, — 9 штаммов;
3) микроорганизмы, имеющие высокий потенциал в поддержании антимикробного воспаления, — 40 штаммов.
При анализе чувствительности к антибиотикам выделенных штаммов было выявлено, что 45% из них имеют признаки резистентности к 1–2 группам лекарственных препаратов, у 33% отмечены признаки поливалентной резистентности к трем и более группам. Эрадикация такой флоры представляет сложности и, с нашей точки зрения, требует назначения комбинированной терапии после исследования биоптата [11].
При оценке количественного состава выделенной микрофлоры у пациентов с легкой степенью заболевания микрофлора в стенке толстой кишки отсутствовала либо определялись низкие титры высеянных штаммов (102–103 КОЕ на биоптат).
У пациентов со средней степенью тяжести и тяжелым течением заболевания в 50,0% и 53,8% соответственно выявлена выраженная микробная контаминация подслизистого слоя (количество микроорганизмов 105–106 КОЕ на биоптат), большое разнообразие видов (более 3).
Согласно клиническим рекомендациям, антибактериальная терапия показана пациентам с тяжелой атакой заболевания при наличии лихорадки или подозрении на кишечную инфекцию, но, по нашему мнению, при этом необходимо учитывать видовой состав микрофлоры и ее чувствительность к антибактериальным препаратам.
В 50% при течении средней степени тяжести и в 46,2% при тяжелой атаке заболевания микробная контаминация стенки толстой кишки отсутствует либо выражена слабо (количество микроорганизмов 102–103 КОЕ на биоптат) и представлена штаммами нормофлоры.
В случае обнаружения у пациентов микрофлоры, участие которой в поддержании воспаления не выявлено, назначение антибактериальной терапии может усугубить дисбиотические проявления и, по нашему мнению, нецелесообразно [11].
При сравнительном анализе результатов микробиологических исследований биоптатов, взятых при фиброколоноскопии, до выполнения оперативного вмешательства (n = 28) и после выполнения колопроктэктомии (n = 7) из биоптатов удаленной части толстой кишки были получены идентичные данные.
По нашему мнению, важность детального исследования видового состава энтерококков у пациентов с ЯК обусловлена высокими рисками распространения их во внутрибольничной среде и формированием множественной лекарственной устойчивости, что согласуется с литературными данными [8, 12].
Выводы
- Всем пациентам с язвенным колитом необходимо исследовать микробный состав кишечной стенки с целью оптимизации тактики проводимого лечения.
- Микроорганизмы в титре 105–106 КОЕ, их большое видовое разнообразие поддерживают воспаление в толстой кишке и препятствуют его купированию.
- Результаты микробиологического исследования стенки толстой кишки у пациентов с обострением язвенного колита могут служить критерием для назначения антибактериальной терапии, а также являться прогностическим признаком при определении показаний к хирургическому лечению.
Литература
- Воробьев Г. И., Халиф И. Л. Неспецифические воспалительные заболевания кишечника. М.: Миклош, 2008. 400 с.
- Ивашкин В. Т., Лапина Т. Л. Гастроэнтерология: национальное руководство. М.: ГЭОТАР-Медиа, 2008. 700 с.
- Комаров Ф. И., Осадчук А. М., Осадчук М. А. и др. Неспецифический язвенный колит. М.: ООО Медицинское информационное агентство, 2008. 256 с.
- Белоусова Е. А. Язвенный колит и болезнь Крона. Тверь: ООО «Изд-во Триада», 2002. 128 с.
- Лягина И. А., Корнева Т. К., Головенко О. В. и др. Характеристика кишечной микрофлоры у больных язвенным колитом // Рос. журн. гастроэнтерол., гепатол. и колопроктол. 2008. № 2. С. 48–54.
- Sandler R. S., Eisen G. M. Epidemiology of inflammatory bowel disease. Inflammatory bowel disease / Ed. J. B. Kirshner. Fifth edition. Saunders, 2000. P. 89–113.
- Жуков Б. Н., Исаев В. Р., Андреев П. С., Каторкин С. Е., Чернов А. А. Комплексное лечение неспецифического язвенного колита с применением эндолимфатической терапии // Новости хирургии. 2012. Т. 20, № 2. С. 49–54.
- Reid K. C., Cockerill F. R. III, Robin Patel. Clinical and Epidemiological Features of Enterococcus casseliflavus/flavescens and Enterococcus gallinarum Bacteremia: A Report of 20 Cases // Clin Infect Dis. 2001, Jun 1; 32 (11): 1540–1546. Epub 2001 Apr 30.
- Лямин А. В., Андреев П. С., Жестков А. В., Жуков Б. Н. Антибиотикорезистентность грамотрицательной микрофлоры, выделенной из биопсийного материала у больных неспецифическим язвенным колитом // Клиническая микробиология и антимикробная химиотерапия. 2010. Т. 12, № 4. С. 342–346.
- Truelove S. C. et al. Cortisone in ulcerative colitis; final report on a therapeutic trial // Br Med J. 1955; 2: 1041–1048.
- Давыдова О. Е., Андреев П. С., Каторкин С. Е. Язвенный колит — особенности диагностики и лечения // Научно-практический журнал гастроэнтерология Санкт-Петербурга. 2017. № 1. С. 76–77.
- Давыдова О. Е., Каторкин С. Е., Лямин А. В., Андреев П. С. Улучшение результатов лечения пациентов с язвенным колитом с использованием индивидуальных схем эрадикационной терапии условно-патогенной микрофлоры, основанных на микробиологическом мониторинге // Врач-аспирант. 2016. Т. 77, № 4. С. 49–55.
О. Е. Давыдова1
П. С. Андреев, кандидат медицинских наук
С. Е. Каторкин, кандидат медицинских наук
А. В. Лямин, кандидат медицинских наук
А. А. Горюнов
И. В. Киселева, кандидат медицинских наук
ФГБОУ ВО СамГМУ МЗ РФ, Самара
1 [email protected]
Источник: https://www.lvrach.ru/2017/08/15436780/
';
blockSettingArray[6]["minSymbols"] = 0;blockSettingArray[6]["minHeaders"] = 0;
jsInputerLaunch = 15;